Fuerzas de Van der Waals
Trabajo realizado por: Lucía Canchales, Nerea Coria y Clara Hidalgo.
Las fuerzas de Van der Waals son relativamente débiles comparadas con los enlaces químicos normales, pero desempeñan un papel fundamental en campos tan diversos como química supramolecular, biología estructural, ciencia de polímeros, nanotecnología, ciencia de superficies y física de la materia condensada. Las fuerzas de Van der Waals definen el carácter químico de muchos compuestos orgánicos. También definen la solubilidad de los alcoholes inferiores. Las propiedades del grupo polar hidroxilo dominan a las débiles fuerzas intermoleculares de Van der Waals. En los alcoholes superiores, las propiedades del radical alquílico apolar (R) dominan y definen la solubilidad. Las fuerzas de Van der Waals crecen con la longitud de la parte no polar de la sustancia.
consta de tres contribuciones distintas:
-La primera fuente de atracción es la interacción electrostática, también denominada interacción de Keesom o fuerza de Keesom en honor a Willem Hendrik Keesom.
-La segunda fuente de atracción es la inducción (también denominada polarización electroquímica), que es la interacción entre un multipolo permanente en una molécula, con un múltiplo inducido en otra. Esta interacción se mide algunas veces en debyes, en honor a Peter Debe.
-La tercera atracción suele ser denominada en honor a Fritz London que la llamaba dispersión. Es la única atracción experimentada por moléculas no polares, pero opera entre cualquier par de moléculas, sin importar su simetría.
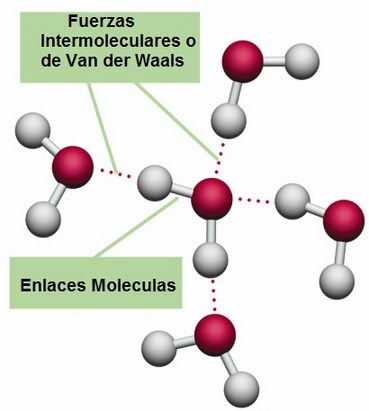 Foto sacada de AREACIENCIAS
Foto sacada de AREACIENCIASEstas fuerzas incluyen atracciones entre átomos, moléculas y superficies. Difieren del enlace covalente y del enlace iónico en que están causados por correlaciones en las polarizaciones fluctuantes de partículas cercanas (una consecuencia de la dinámica cuántica). Las fuerzas intermoleculares tienen cuatro contribuciones importantes. En general, un potencial intermolecular tiene un componente repulsivo que evita el colapso de las moléculas, debido a que al acercarse las entidades unas a otras las repulsiones dominan.
Todas las fuerzas intermoleculares de Van der Waals presentan anisotropía excepto aquellas entre átomos de dos gases nobles, lo que significa que dependen de la orientación relativa de las moléculas. Las interacciones de inducción y dispersión son siempre atractivas, sin importar su orientación, pero el signo de la interacción cambia con la rotación de las moléculas. Esto es la fuerza electrostática que puede ser atractiva o repulsiva, dependiendo de la orientación mutua de las moléculas.
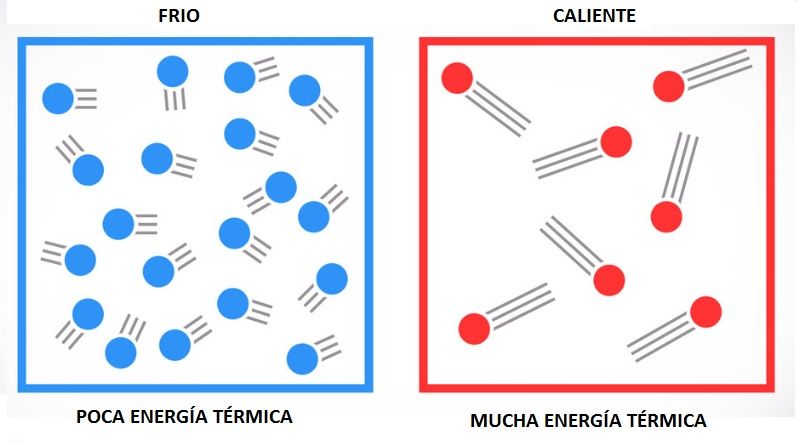 Foto sacada de AREACIENCIAS
Foto sacada de AREACIENCIASCuando las moléculas tienen movimiento térmico, como cuando están en fase gaseosa o líquida, la fuerza electrostática se reduce significativamente, debido a que las moléculas rotan térmicamente y experimentan las partes repulsivas y atractivas de la fuerza electrostática. Algunas veces, este efecto se expresa indicando que el «movimiento térmico aleatorio a temperatura ambiente puede imponerlo o anularlo», refiriéndose al componente electrostático de la fuerza de Van der Waals. Claramente, el efecto térmico promedio es mucho menos pronunciado para las fuerzas atractivas de inducción y dispersión.
Bibliografía:



No hay comentarios:
Publicar un comentario